L’ipersuscettibilità è una abnorme reattività a concentrazioni di una sostanza che nella maggior parte dei soggetti non provocano alcun effetto: parlando di
tossici, all’interno di una popolazione nella maggior parte dei casi non si hanno alterazioni dello stato di salute quando esposta ad una certa concentrazione del
tossico, mentre, una piccola percentuale, sottoposta alla stessa concentrazione, manifesta alterazioni dello stato di salute.
È dovuta alla variabilità individuale, ossia, alle diverse
caratteristiche biologiche dei singoli individui di una stessa popolazione.
È possibile dimostrarla attraverso l’analisi delle curve dose-risposta è possibile rilevare la percentuale di soggetti che mostrano una specifica variazione quantitativa di un parametro di un effetto a ogni dato livello di
dose .
Le ipersuscettibilità possono essere congenite o acquisite:
- Le congenite sono rappresentate da numerose alterazioni genetiche che possono condizionare un’ipersuscettibilità a fattori di rischio occupazionali.
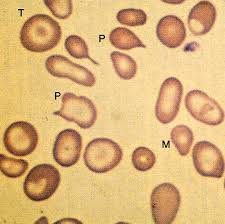
Tali alterazioni riguardano enzimi coinvolti nei processi metabolici o di detossificazione. Un esempio è rappresentato dal deficit di glucosio-6- fosfato deidrogenasi: questo enzima interviene nei processi che proteggono la cellula dallo stress ossidativo (mantiene ridotti i gruppi –SH del glutatione), pertanto, nei portatori di tale alterazione, si hanno episodi di emolisi acuta dopo esposizione a sostanze ossidanti quali le fave, alcuni farmaci (antimalarici, sulfamidici) o tossici industriali quali il piombo o l’idrogeno aresenicale (questi composti ossidano in glutatione)
Tale alterazione fa sì che episodi di emolisi acuti provocati dai tossici professionali ad elevate dosi, si verificano anche in lavoratori esposti a dosi minore di tossico ma portatori di tale alterazione
- Le ipersuscettibiltià acquisite possono essere distinte in:
- Fisiologiche: dipendono dall’età (negli anziani le attività enzimatiche sono ridotte), dal sesso femminile (è dimostrate che, a parità di dose interna, nelle donne l’effetto tossico del piombo è più marcato: è dimostrato dai livelli più elevati di zincoprotoporfirina eritrocitaria e di acido aminolevulinico urinario), la gravidanza (nelle prime fasi di gestazione, quando la donna non può ancora allontanarsi dal lavoro, è particolarmente esposto il prodotto del concepimento).
- Patologiche: anemia, epatopatie, bpco, nefropatie, deficit immunitari (per esposizioni a pesticidi o radiazioni ionizzanti).
- Voluttuarie: ad esempio il consumo di alcool.
Sorveglianza sanitaria dei lavoratori ipersuscettibili
Nella fase di avviamento al lavoro devono essere ricercate tutte le condizioni, congenite o acquisite che possono influenzare la suscettibilità del lavoratore che svolge una specifica attività lavorativa, mentre, con il monitoraggio biologico, sarà possibile riconoscere in tempo i soggetti ipersuscettibili.
( nel Foà si fa notare una cosa simpatica: non è una opportuna strategia quella di tenere in un ambiente lavorativo inquinato solo soggetti iposuscettibili evitando di attuare tutte le misure per ridurre l’inquinamento ambientale ma l’approccio deve andare proprio nella direzione opposta, ossia, bisogna cercare di ridurre al minimo l’inquinamento ambientale in modo da permettere anche agli ipersuscettibili di poter lavorare in quell’ambiente lavorativo).
[Bibliografia: Medicina Del Lavoro-UTET]
Immagini by Google